스트레스 방지 보호제로서의 젖산?
- 기초과학 / 문광주 기자 / 2025-09-15 20:35:59
3분 읽기
- 근육과 지방 세포는 스트레스 상황에서 에너지 균형을 유지하기 위해 젖산을 생성
- 젖산은 철분과 함께 산화 스트레스로부터 세포를 보호할 수 있다
- 향후 암, 신경 퇴행성 질환, 염증성 질환 치료에도 도움
많은 사람이 젖산의 염인 젖산에 대해 잘 알고 있으며, 이는 주로 운동에서 생성된다. 젖산은 신체 활동과 산소 결핍 시 근육 세포에서 생성된다. 지방 세포 또한 지방 저장을 조절하는 메신저 물질이자 중간체인 젖산을 생성한다. 두 경우 모두, 이 분자는 에너지 균형을 유지하는 역할을 한다. 출발 물질은 포도당이며, 포도당은 피루브산으로, 그리고 다시 젖산으로 전환된다.
또한 젖산 분자는 종양 세포, 뇌의 성상세포, 섬유아세포 및 염증 과정 중 다른 면역 세포와 같은 다른 세포 유형에서도 생성된다. 놀라운 점은 이러한 세포들이 화학 반응에 쉽게 참여할 수 있는 비결합 철(Fe2+)을 다량 함유하고 있다는 것이다. 그러나 철분이나 젖산 모두 세포에 유익하지 않다. 그렇다면 이 두 가지의 동시 발생은 우연의 일치일까, 아니면 연관성이 있을까?
과산화수소에 젖산과 철분을 사용하는 것일까?
에센 대학 병원의 아스트리드 헨젤(Astrid Hensel)이 이끄는 연구팀은 이 의문을 조사했다. 연구진은 젖산과 철분이 공격적인 산소 화합물로 인한 산화 스트레스로부터 세포를 방어하는 데 함께 작용할 수 있다는 가설을 세웠다. 뒤스부르크-에센 대학교의 선임 저자인 셜리 크나우어(Shirley K. Knauer)는 "많은 세포가 종양, 바이러스 감염, 자가면역 질환 등에서 산화 스트레스에 노출된다"며 "저희의 가설은 젖산이 철과 함께 유해한 과산화수소를 중화하는 세포 보호막 역할을 할 수 있다는 것이다"고 설명했다.
과산화수소(H₂O₂)는 미토콘드리아와 면역 반응 과정에서 유용한 신호 전달 물질로 생성된다. 그러나 과산화수소가 너무 많이 생성되면 이를 담당하는 효소가 이를 더 완전히 분해할 수 없게 된다. 과산화수소는 DNA, 지질, 단백질과 같은 중요한 세포 구성 요소를 공격하여 세포 사멸을 초래할 수 있다. 이 이론에 따르면, 젖산은 이전에 간과되었던 세포 내 해독 시스템을 형성하여 이를 방지할 수 있다.
젖산은 스스로를 "희생"하는 것일까?
헨젤과 동료들은 생화학적 과정에 대한 문헌 자료를 활용하여 세포에서 정확히 어떤 일이 일어날 수 있는지 조사했다. 그들은 건강한 세포보다 종양 세포에서 더 활성적인 유전자를 찾았다. 분자생물학자들은 실제로 종양 세포에 더 많은 철분과 젖산을 축적하는 데 기여하는 여러 유전자를 발견했다. 따라서 연구팀은 암세포가 의도적으로 이러한 물질을 축적한다고 추정한다. 도대체 그렇게 하는 데 어떤 이점이 있을까?
이전 연구에서는 철 이온과 과산화수소가 소위 펜톤 반응(Fenton reaction)을 통해 반응 히드록실 라디칼(H2O·)을 생성한다는 것을 보여주었다. 이 라디칼은 과산화수소보다 반응성이 훨씬 더 강하여 세포에 더 해롭다. 그러나 다량의 젖산이 동시에 존재하면 이 라디칼은 더 반응하여 물과 피루브산을 형성할 수 있다. 세포는 이러한 무독성 생성물을 신진대사에 활용하여 생존할 뿐만 아니라 성장까지 할 수 있다.
핵심은 "이러한 반응성이 높은 라디칼은 강력한 산화력을 가지고 있으며, 처음 접하는 기질과 반응한다"라고 연구팀은 기술했다. 히드록실 라디칼이 젖산과 즉시 반응하고 다른 세포 구성 요소와는 반응하지 않으려면, 다른 기질이 철-젖산 복합체 형태로 존재해야 한다. 헨젤은 "젖산은 세포의 필수 구성 요소를 공격하기 전에 스스로를 희생하여 특히 공격적인 산소 형태를 포획한다"고 설명했다.
잠재적 치료 표적
이 이론을 실험적으로 검증하기 위한 후속 연구가 진행될 예정이다. 젖산-철 조합은 향후 의학 분야에서 새로운 접근법으로 활용될 수 있다. 헨젤은 "이 가설이 확증된다면, 그 기전이 구체적으로 영향을 받을 수 있다. 예를 들어 암 치료에서는 종양 세포의 보호막을 약화시켜 치료에 더 민감하게 반응하도록 할 수 있다"며 "그러나 자가면역 질환이나 알츠하이머병과 같은 신경퇴행성 질환의 경우, 목표는 정반대다. 산화 스트레스로 인한 손상으로부터 취약한 세포를 더 잘 보호하기 위해 보호막을 강화해야 한다"고 말했다. 연구진은 또한 철-젖산 보호막의 이러한 변형에 적합할 것으로 생각되는 다양한 물질을 제안했다.
참고: Redox Biology, 2025; doi: 10.1016/j.redox.2025.103754)
출처: Universität Duisburg-Essen
- 근육과 지방 세포는 스트레스 상황에서 에너지 균형을 유지하기 위해 젖산을 생성
- 젖산은 철분과 함께 산화 스트레스로부터 세포를 보호할 수 있다
- 향후 암, 신경 퇴행성 질환, 염증성 질환 치료에도 도움
스트레스 방지 보호제로서의 젖산?
젖산과 철분이 어떻게 스트레스 받은 신체 세포를 방어할 수 있을까?
간과되었던 보호 기전?
근육과 지방 세포는 스트레스 상황에서 에너지 균형을 유지하기 위해 젖산을 생성한다. 하지만 다른 신체 세포에서는 이 분자가 또 다른 중요한 기능을 하는 것으로 보인다. 한 연구에 따르면, 젖산은 철분과 함께 산화 스트레스로부터 세포를 보호할 수 있다. 따라서 젖산은 이전에는 간과되었던 방어 시스템을 형성한다. 만약 이 기전이 확인된다면, 향후 암, 신경 퇴행성 질환, 염증성 질환 치료에도 도움이 될 수 있다.
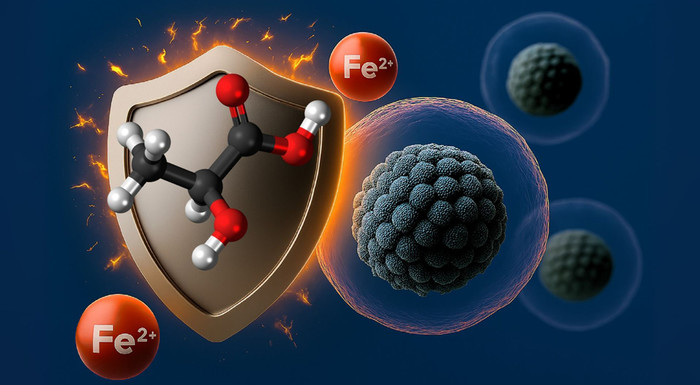 |
| ▲ 세포 보호막의 은유적 표현: 젖산 분자는 철과 함께 방어 시스템 역할을 한다. © UKE/Astrid Hensel, AI로 생성 |
많은 사람이 젖산의 염인 젖산에 대해 잘 알고 있으며, 이는 주로 운동에서 생성된다. 젖산은 신체 활동과 산소 결핍 시 근육 세포에서 생성된다. 지방 세포 또한 지방 저장을 조절하는 메신저 물질이자 중간체인 젖산을 생성한다. 두 경우 모두, 이 분자는 에너지 균형을 유지하는 역할을 한다. 출발 물질은 포도당이며, 포도당은 피루브산으로, 그리고 다시 젖산으로 전환된다.
또한 젖산 분자는 종양 세포, 뇌의 성상세포, 섬유아세포 및 염증 과정 중 다른 면역 세포와 같은 다른 세포 유형에서도 생성된다. 놀라운 점은 이러한 세포들이 화학 반응에 쉽게 참여할 수 있는 비결합 철(Fe2+)을 다량 함유하고 있다는 것이다. 그러나 철분이나 젖산 모두 세포에 유익하지 않다. 그렇다면 이 두 가지의 동시 발생은 우연의 일치일까, 아니면 연관성이 있을까?
 |
| ▲ 연구 개요: 산화 스트레스에 대한 보호 메커니즘으로서의 바르부르크 효과: H2O2 해독 과정의 젖산과 Fe2+.(출처:Raising the iron curtain: Lactate's secret role in oxidative stress defense / Redox Biology / Volume 85, September 2025, 103754) |
과산화수소에 젖산과 철분을 사용하는 것일까?
에센 대학 병원의 아스트리드 헨젤(Astrid Hensel)이 이끄는 연구팀은 이 의문을 조사했다. 연구진은 젖산과 철분이 공격적인 산소 화합물로 인한 산화 스트레스로부터 세포를 방어하는 데 함께 작용할 수 있다는 가설을 세웠다. 뒤스부르크-에센 대학교의 선임 저자인 셜리 크나우어(Shirley K. Knauer)는 "많은 세포가 종양, 바이러스 감염, 자가면역 질환 등에서 산화 스트레스에 노출된다"며 "저희의 가설은 젖산이 철과 함께 유해한 과산화수소를 중화하는 세포 보호막 역할을 할 수 있다는 것이다"고 설명했다.
과산화수소(H₂O₂)는 미토콘드리아와 면역 반응 과정에서 유용한 신호 전달 물질로 생성된다. 그러나 과산화수소가 너무 많이 생성되면 이를 담당하는 효소가 이를 더 완전히 분해할 수 없게 된다. 과산화수소는 DNA, 지질, 단백질과 같은 중요한 세포 구성 요소를 공격하여 세포 사멸을 초래할 수 있다. 이 이론에 따르면, 젖산은 이전에 간과되었던 세포 내 해독 시스템을 형성하여 이를 방지할 수 있다.
젖산은 스스로를 "희생"하는 것일까?
헨젤과 동료들은 생화학적 과정에 대한 문헌 자료를 활용하여 세포에서 정확히 어떤 일이 일어날 수 있는지 조사했다. 그들은 건강한 세포보다 종양 세포에서 더 활성적인 유전자를 찾았다. 분자생물학자들은 실제로 종양 세포에 더 많은 철분과 젖산을 축적하는 데 기여하는 여러 유전자를 발견했다. 따라서 연구팀은 암세포가 의도적으로 이러한 물질을 축적한다고 추정한다. 도대체 그렇게 하는 데 어떤 이점이 있을까?
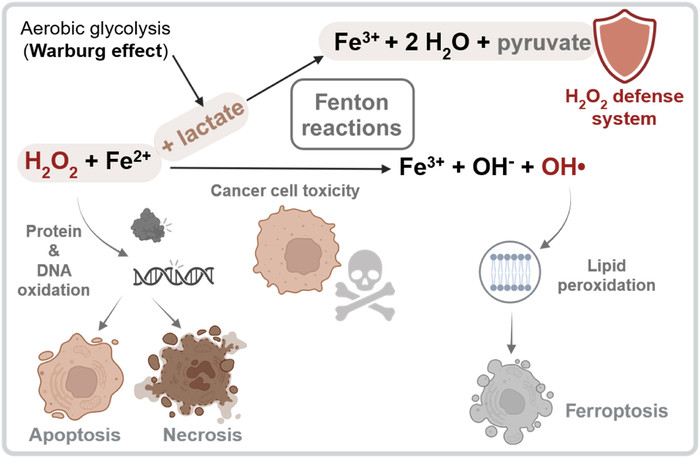 |
| ▲ 제1철(Fe₂+)과 젖산은 펜톤(Fenton) 기반 H₂O₂ 해독에서 협력한다. 단백질이 없는 H₂O₂ 소거 시스템은 세포질에서 가용성 Fe₂+와 젖산과 같은 산화성 대사산물을 이용하여 펜톤 반응을 통한 H₂O₂ 분해를 촉진한다. 이 과정에서 Fe₂+는 H₂O₂로 전자를 전달하여 반응성이 높은 히드록실 라디칼(HO·)을 생성합니다. 이러한 라디칼은 확산 제어 속도로 반응하여 첫 번째 기질과 즉시 상호작용한다. 세포질 농도가 높아지면 젖산은 히드록실 라디칼 소거제 역할을 하여 필수 생체 분자를 산화적 손상으로부터 보호한다. 불안정한 철 풀(LIP)이 낮고 젖산 생성이 적은 세포에서 과도한 H₂O₂는 단백질과 DNA를 산화시켜 세포자멸사 또는 괴사를 유발할 수 있다. 반대로, H₂O₂와 세포질 Fe₂+가 모두 풍부하지만 젖산과 같은 산화 가능한 대사산물이 부족하면, 생성된 히드록실 라디칼이 지질을 우선적으로 산화시켜 페롭토시스를 유발한다. Biorender.com에서 제작. (출처:Raising the iron curtain: Lactate's secret role in oxidative stress defense / Redox Biology / Volume 85, September 2025, 103754) |
이전 연구에서는 철 이온과 과산화수소가 소위 펜톤 반응(Fenton reaction)을 통해 반응 히드록실 라디칼(H2O·)을 생성한다는 것을 보여주었다. 이 라디칼은 과산화수소보다 반응성이 훨씬 더 강하여 세포에 더 해롭다. 그러나 다량의 젖산이 동시에 존재하면 이 라디칼은 더 반응하여 물과 피루브산을 형성할 수 있다. 세포는 이러한 무독성 생성물을 신진대사에 활용하여 생존할 뿐만 아니라 성장까지 할 수 있다.
핵심은 "이러한 반응성이 높은 라디칼은 강력한 산화력을 가지고 있으며, 처음 접하는 기질과 반응한다"라고 연구팀은 기술했다. 히드록실 라디칼이 젖산과 즉시 반응하고 다른 세포 구성 요소와는 반응하지 않으려면, 다른 기질이 철-젖산 복합체 형태로 존재해야 한다. 헨젤은 "젖산은 세포의 필수 구성 요소를 공격하기 전에 스스로를 희생하여 특히 공격적인 산소 형태를 포획한다"고 설명했다.
잠재적 치료 표적
이 이론을 실험적으로 검증하기 위한 후속 연구가 진행될 예정이다. 젖산-철 조합은 향후 의학 분야에서 새로운 접근법으로 활용될 수 있다. 헨젤은 "이 가설이 확증된다면, 그 기전이 구체적으로 영향을 받을 수 있다. 예를 들어 암 치료에서는 종양 세포의 보호막을 약화시켜 치료에 더 민감하게 반응하도록 할 수 있다"며 "그러나 자가면역 질환이나 알츠하이머병과 같은 신경퇴행성 질환의 경우, 목표는 정반대다. 산화 스트레스로 인한 손상으로부터 취약한 세포를 더 잘 보호하기 위해 보호막을 강화해야 한다"고 말했다. 연구진은 또한 철-젖산 보호막의 이러한 변형에 적합할 것으로 생각되는 다양한 물질을 제안했다.
참고: Redox Biology, 2025; doi: 10.1016/j.redox.2025.103754)
출처: Universität Duisburg-Essen
[더사이언스플러스=문광주 기자]
[ⓒ the SCIENCE plus. 무단전재-재배포 금지]